Pengertian Larutan dan Klasifikasinya - Kimia Kelas 11

Sobat Zenius pasti pernah bikin minuman kayak teh manis gitu, kan? Elo tahu nggak, sih, kalau gula yang bercampur dengan baik di dalam air (homogen) itu disebut dengan larutan. Nah, dalam artikel ini gue akan membahas pengertian larutan, klasifikasi & sifat-sifatnya.
“Jono, tolong buatkan Bapakmu teh manis anget ya!”
“Siap laksanakan, Bu”
Jono langsung menuju dapur dan mempersiapkan tehnya. Saat Jono memasukkan gula ke dalam air panas dan mengaduknya, gula tersebut langsung melebur dan homogen dengan air.
Dari situ Jono mulai berpikir, “Kenapa ya kok gula dicampur air menjadi homogen?”
Pertanyaan Jono ternyata bisa dijawab dengan konsep larutan kimia, lho. Dilihat dari sudut pandang materi larutan termasuk jenis campuran homogen, ya, Sobat Zenius!
Nah, daripada elo penasaran, yuk, simak materi larutan dalam artikel ini secara lengkap!
Apa Itu Larutan?
Sobat Zenius, kira-kira apa yang dimaksud dengan larutan, ya?
Larutan adalah campuran homogen dari dua atau lebih zat. Nah, larutan terdiri atas dua komponen yaitu zat terlarut dan zat pelarut yang sifatnya homogen.
- Zat pelarut: zat yang melarutkan zat lainnya.
- Zat terlarut: zat yang dilarutkan ke dalam pelarut.
Nah, kalau ditanya gini “jelaskan tentang zat terlarut dan pelarut” apa yang ada di benak elo?
Umumnya, pelarut jumlahnya akan lebih banyak daripada zat terlarutnya. Hal itu supaya zat terlarut bisa tercampur secara homogen.
Maksud dari homogen berarti yang larut sempurna, ya. Contohnya garam. Jika garam dimasukkan ke dalam air maka disebut zat terlarut. Hasilnya si garam akan melebur dan homogen dengan air.Selain itu, air gula dapat disebut larutan karena ketika gula larut dalam air dan melebur, maka larutannya sama sehingga bersifat homogen.

Kok bisa, ya?
Oke, mari kita bahas. Air merupakan pelarut universal, banyak zat yang bisa larut di dalamnya.
Sedangkan NaCl merupakan zat terlarutnya. Ketika molekul NaCl dilarutkan dengan molekul air, maka air akan membantu proses pelarutannya, sehingga akan membentuk ion Na+ dan Cl- yang terpisah.
Nah, yang namanya ion itu kan ada positif (+) dan negatif (-). Jadi, kutub negatif NaCl (Cl-) akan bertemu dengan kutub positif H2O (H+). Sedangkan, kutub positif NaCl (Na+) akan bertemu dengan kutub negatif H2O (O-). Ilustrasinya bisa elo lihat pada gambar di atas.
Baca juga: Larutan Basa: Materi Kimia Kelas 11
Apa sih yang menarik?
Ternyata, larutan itu nggak selamanya berbentuk zat cair, guys. Ada larutan berbentuk gas atau padatan.
Contohnya udara yang merupakan campuran gas homogen (zat pelarut dan terlarutnya sama-sama gas). Contoh lainnya pada kuningan dan perunggu, nah ini antara zat terlarut dan pelarutnya sama-sama berbentuk padatan.
Jadi, jelas ya kalau larutan itu nggak selamanya berbentuk cair.
Sobat Zenius sudah paham, kan, pengertian larutan? Kalau sudah, sebelum lanjut ke pembahasan berikutnya, gue punya kabar gembira buat elo, nih!
Yap, elo bisa dapetin beragam contoh soal dan pembahasan yang menarik dari berbagai macam mata pelajaran lewat aplikasi dari Zenius!
Nggak cuman itu aja, elo juga bisa melatih otak dengan ikut ZenCore dan belajar lewat video pembelajaran yang ciamik dari Zen Tutor!
Jadi, tunggu apa lagi? Yuk, segera download aplikasinya dengan klik banner di bawah ini!
Klasifikasi Larutan
Elo udah pernah dengar tentang larutan polar dan non polar belum? Atau gini deh, elo pasti pernah minum minuman elektrolit kan, baik itu yang bermerek seperti Pocari Sweat atau yang ala rumahan seperti air kelapa dan air garam.
Kalau elo pernah minum minuman elektrolit, elo tahu gak sih apa yang dimaksud dengan elektrolit? Ada elektrolit berarti ada non elektrolit dong? Yap, jenis larutan berdasarkan zat terlarutnya dapat dibedakan menjadi dua, yaitu larutan elektrolit dan non elektrolit.
Baca juga: Larutan Elektrolit dan Non Elektrolit – Materi Kimia Kelas 10
Larutan Elektrolit
Ternyata elektrolit itu larutan yang zat terlarutnya dapat terionisasi, dan larutan ini bisa menghantarkan listrik lho, guys. Contoh larutannya yaitu senyawa kovalen polar dan ionik (garam, basa, dan asam).
Di larutan elektrolit juga terbagi lagi jenisnya, yaitu elektrolit kuat dan elektrolit lemah.
- Elektrolit kuat merupakan larutan yang zat terlarutnya mengalami ionisasi sempurna.

Contoh: asam kuat, basa kuat, dan garam.
- Elektrolit lemah merupakan larutan yang zat terlarutnya mengalami ionisasi sebagian, dengan kata lain ada yang ion positif dan negatifnya masih menyatu.
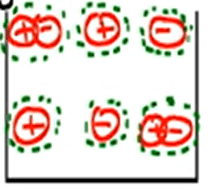
Contoh: asam lemah dan basa lemah.
Larutan Non Elektrolit
Kebalikannya dengan larutan elektrolit, ada juga nih yang dinamakan non elektrolit. Larutan ini zat terlarutnya gak terionisasi dan gak bisa menghantarkan listrik. Contohnya senyawa kovalen non polar (gula, urea, dan minyak).
Jadi, bisa kita simpulkan dari kedua jenis larutan di atas, yaitu:
“Zat terlarut yang dilarutkan ke dalam pelarut kemudian menghasilkan ion-ion merupakan larutan elektrolit. Sedangkan zat terlarut yang dilarutkan ke dalam pelarut tidak menghasilkan ion-ion merupakan larutan non elektrolit”
Sifat Larutan
Sebelumnya kita udah ngomongin pengertian larutan dan klasifikasinya. Kurang lengkap rasanya kalau kita udah ngomongin sesuatu tanpa memahami sifatnya.
Sama kayak doi, kita udah ngestalk semua kehidupannya, tapi kita nggak tahu secara pasti bagaimana sifatnya, kurang nggak? Kurang ya.
Maka dari itu, yuk kita kenali juga sifat larutan!
- Larutan merupakan campuran yang homogen. Kalau gak homogen atau ada endapan (contohnya pasir yang dimasukkan ke dalam air) disebut suspensi, bukan larutan.
- Partikelnya berukuran kecil dan memiliki diameter kurang dari 1 nm. Jadi, gak bisa dilihat dengan mata telanjang.
- Antara zat pelarut dan terlarut gak bisa dibedakan, anggap saja komponen yang lebih banyak dinamakan zat pelarut dan yang lebih sedikit disebut zat terlarut.
- Komponen-komponen suatu campuran gak bisa dipisahkan menggunakan filtrasi atau saringan (karena udah homogen).
Baca juga: Mengenal Larutan Alkohol dan Fungsinya – Materi Kimia Kelas 12
Contoh Soal Klasifikasi Larutan
Nah, kalau udah bahas pengertian larutan, dll, mari kita asah otak dengan contoh-contoh soalnya.
Di bawah ini, ada beberapa contoh soal dan pembahasan tentang klasifikasi larutan, nih, Sobat Zenius!
Contoh Soal 1
Berdasarkan daya hantar listrik, larutan dibedakan menjadi larutan elektrolit dan non elektrolit. Sebutkan contoh larutan non elektrolit beserta alasannya!
Jawab:
Larutan gula C12H22O11 merupakan larutan non elektrolit, karena tidak menghasilkan ion-ion setelah dilarutkan.
Ingat! Larutan non elektrolit adalah larutan yang gak menghasilkan ion-ion setelah dilarutkan. Singkatnya, setiap larutan asam, basa, dan garam yang dilarutkan ke dalam air akan mengalami ionisasi, sehingga dikatakan sebagai larutan elektrolit.
Sedangkan senyawa lainnya adalah non elektrolit.
Contoh Soal 2
- Air dan pasir
- Air dan gula
- Air dan garam
- Air dan alkohol
- Air dan asam cuka
Di antara pilihan di atas, manakah yang bukan termasuk larutan?
Jawab:
Air dan pasir.
Ingat! Larutan terjadi ketika zat terlarut tersebar secara merata di antara pelarutnya dan dengan kasat mata akan tampak homogen. Sedangkan, air dan pasir termasuk campuran (tidak homogen), sehingga bukan larutan.
Itu dia penjelasan singkat mengenai pengertian larutan, klasifikasi, dan sifatnya. Semoga setelah membaca artikel ini elo jadi semakin paham, ya!
Kalau elo lebih tertarik belajar lewat video pembelajaran, elo bisa kok mengaksesnya dari Zenius.
Zen Tutor akan menjelaskan secara detail, lho! Nggak cuman itu, ada juga contoh soal dan pembahasan yang bisa elo pelajari.
Klik banner di bawah ini buat mengaksesnya, ya!
Supaya proses belajar lo semakin efektif, Zenius punya beberapa paket belajar yang bisa lo pilih sesuai kebutuhan lo. Di sini lo nggak cuman mereview materi aja, tetapi juga ada latihan soal untuk mengukur pemahaman lo. Yuk klik banner di bawah ini untuk berlangganan!
Originally published: December 21, 2021
Updated by: Maulana Adieb & Rizaldi Abror









