Halo Sobat Zenius! Di artikel kali ini gue bakalan membahas mengenai teori mekanika kuantum.
Tapi sebelum itu gue pengen nanya, sebelumnya elo sudah mempelajari tentang teori Bohr, bukan? Nah, ternyata teori Bohr memiliki banyak kelemahan lho, guys.
Ia hanya menjelaskan tentang kulit atom saja, selain itu ia juga tidak menjelaskan spektrum pancar atom yang mengandung lebih dari satu elektron. Padahal, di balik kulit atom terdapat yang namanya subkulit dan di dalamnya lagi terdapat orbital.
Setelah mengetahui kelemahan teori Bohr, maka para ahli mencoba untuk mengemukakan teori-teorinya.
Teori itulah yang menjadi dasar dari mekanika kuantum. Yuk, simak lebih jauh penjelasan di bawah ini!
Teori Mekanika Kuantum Menurut Ahli
Max Planck
Max Planck merupakan seorang fisikawan Jerman yang dianggap sebagai bapak mekanika kuantum. Ia mematahkan teori fisika klasik yang mengatakan bahwa cahaya merupakan suatu gelombang.
Teori fisika klasik tersebut bertahan lama hingga Planck menemukan teori baru dan sangat revolusioner, yaitu gelombang cahaya termasuk dalam gelombang dan suatu partikel.
Louis de Broglie
Louis de Broglie menyatakan bahwa partikel kecil yang bergerak sangat cepat seperti elektron memiliki sifat seperti gelombang. De Broglie merumuskan suatu persamaan dimana panjang gelombang yang ditimbulkan ketika suatu partikel bergerak. Persamaannya bisa dilihat sbb:
Keterangan:
λ = panjang gelombang
h = ketetapan planck
m = massa
v = cepat rambat gelombang
Werner Heisenberg
Teori menurut Heisenberg ini biasa disebut juga sebagai teori ketidakpastian. Mengapa disebut sebagai teori ketidakpastian? Hal ini karena posisi dan momentum elektron tidak bisa ditentukan secara pasti.
Erwin Schrodinger
Dari teori de Broglie dan Heisenberg, maka muncullah teori atom mekanika gelombang dikemukakan oleh Schrodinger yang menyatakan bahwa posisi dan momentum elektron tidak bisa ditentukan secara pasti.
Yang bisa ditentukan adalah probabilitas (kemungkinan daerahnya) menemukan elektron. Daerah dengan probabilitas menemukan elektron terbesar disebut dengan orbital.
Untuk menemukan tingkat energi, bentuk, dan orientasi orbital, maka teori mekanika kuantum yang dikemukakan Erwin Schrodinger mencakup tiga jenis bilangan kuantum yang terdiri dari bilangan kuantum utama, azimut, dan magnetik. Selengkapnya akan dibahas pada bagian bilangan kuantum di bawah ini.
Model Atom Mekanika Kuantum
Sebelum kita ke bilangan kuantum, alangkah baiknya kita mengenal model atom mekanika kuantum terlebih dahulu. Tak kenal maka… tak paham dong. Yuk langsung aja kita bahas!
Model atom mengalami perkembangan dari yang pertama yaitu model atom Dalton, kemudian disempurnakan oleh Thomson, masih kurang sempurna dan disempurnakan lagi oleh Rutherford.
Selanjutnya Bohr, dan ternyata masih ada kelemahan hingga akhirnya berkembang lagi menjadi model atom Mekanika Kuantum hingga saat ini.
Model Atom Dalton
Dalton menyebutkan bahwa partikel terkecil dari suatu materi disebut atom. Jadi, ketika ada suatu benda kemudian dibagi dan dibagi terus menerus sampai kecil, hingga ditemukan benda tersebut sudah tidak bisa dibagi lagi, itu disebut atom.
Model Atom Thomson
Ternyata, Thomson menemukan bahwa bagian terkecil dari suatu materi bukanlah atom. Sehingga, teori Dalton menjadi runtuh. Ia menemukan partikel penyusun atom. Thomson menemukan partikel sub atomik yang bermuatan negatif, bernama elektron atau sinar katoda.
Teori Thomson menyatakan bahwa atom memiliki muatan yang bernilai positif, kemudian terdapat partikel-partikel negatif yang menyelimuti atom tersebut, sehingga bentuknya seperti roti kismis. Maka dari itu model atom Thomson dikenal dengan sebutan model bola kismis.
Model Atom Rutherford
Selanjutnya Rutherford ingin membuktikan apakah teori Thomson benar atau tidak. Ternyata, ditemukan bahwa atom terdiri dari rongga-rongga kosong dan terdapat inti atom yang bermuatan positif. Nah, massa atom itu berpusat di inti, sehingga elektron tidak berpengaruh terhadap massa atom.
Model Atom Bohr
Ternyata, model atom Rutherford diketahui memiliki beberapa kelemahan teori nih, guys. Sehingga, Niels Bohr dan Ernest Rutherford melakukan percobaan lagi, hingga akhirnya dicetuskan model atom Bohr. Model ini menyatakan bahwa atom terdiri dari inti atom yang mengandung proton dan neutron yang dikelilingi oleh elektron.
Jadi, si elektron ini berputar dalam orbitnya dengan tingkatan energi tertentu. Tingkat energi tertentu itulah yang dinamakan dengan orbit atau kulit atom (n), yaitu K, L, M, N.
Tapi, model atom Bohr ini ternyata ada kelemahannya. Ia hanya dapat menjelaskan spektrum dari atom atau ion yang berelektron tunggal.
Model Atom Mekanika Kuantum
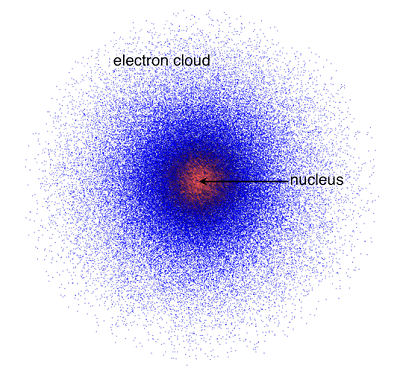
Model atom terakhir yang masih eksis hingga saat ini adalah mekanika kuantum. Model ini menyatakan bahwa atom terdiri dari inti atom yang bermuatan positif dan dikelilingi oleh awan-awan elektron. Dari teori inilah ditemukan empat jenis orbital, yaitu s, p, d, f. Berikut gambaran modelnya:
Sebelum lanjut, yuk download dulu aplikasi Zenius. Elo bisa dapetin akses ke ribuan materi pelajaran, latihan soal, dan fitur-fitur gratis Zenius. Tinggal klik aja gambar di bawah sesuai gadget elo, ya!
Bilangan Kuantum
Nah, sekarang kita mengenal macam-macam bilangan kuantum, yuk!
Bilangan Kuantum Utama (n)
Bilangan kuantum utama menyatakan tingkat energi utama elektron yang dimiliki dari suatu atom. Bilangan ini dilambangkan dengan n yang melambangkan kulit atom pada model atom Bohr.
Kita review kembali bahwa pada model atom Bohr terdapat jenis kulit K (n=1), L (n=2), M (n=3), N (n=4), O (n=5), dst. Semakin besar nilai n, maka akan semakin besar juga ukuran orbital dan tingkat energinya.
Bilangan Kuantum Azimut (l)
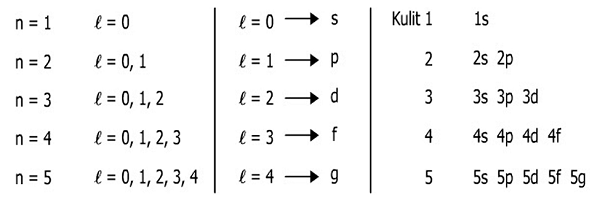
Kalau tadi bilangan kuantum utama menyatakan kulit atom, nah kalau bilangan azimuth ini menyatakan suatu bentuk orbital atau sub-kulit atom.
Lalu, banyaknya sub kulit ini tergantung pada banyaknya tingkat energi utama (kulit). Maksudnya begini, kalau jumlah kulit (n) adalah 1, maka sub kulit (l) yang diperbolehkan hanya 1. Coba deh lihat di bawah ini:
Begitu seterusnya, tapi untuk saat ini belum ditemukan atom yang elektronnya mengisi sub kulit 5g, sehingga hanya dibahas sampai sub kulit s, p, d, dan f.
Bilangan Kuantum Magnetik (m)
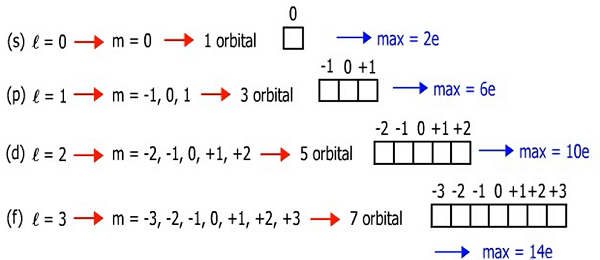
Selanjutnya adalah bilangan kuantum magnetik yang dilambangkan dengan m. Bilangan ini menyatakan orientasi dari orbital, bentuk khusus orbital, atau ukuran orbital. Dimana nilai m yang diperbolehkan yaitu m = –l sampai +l.
Dari gambar di atas, kamu bisa mengetahui bahwa sub kulit s (l=0) memiliki harga m=0 yang artinya dia hanya punya 1 buah orbital. Kemudian, sub kulit p (l=1) memiliki harga m=-1, 0, 1 yang artinya dia memiliki 3 buah orbital. Begitu deh seterusnya.
Bilangan Kuantum Spin (s)
Bilangan kuantum yang terakhir adalah spin atau dilambangkan dengan huruf s. Tahukah kamu bahwa selain berevolusi mengelilingi inti, ternyata elektron juga berotasi lho, guys.
Nah, itulah yang akan dibahas pada bilangan kuantum spin, dimana bilangan ini akan mendeskripsikan arah spin elektron di dalam orbital. Harga s yang diperbolehkan adalah – ½ atau + ½.
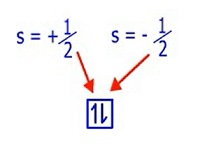
Harga s = + ½ dilambangkan dengan tanda panah mengarah ke atas, sedangkan untuk harga s = – ½ dilambangkan dengan tanda panah yang mengarah ke bawah. Dalam penulisannya, tanda panah mengarah ke atas harus diutamakan atau didahulukan.
Konfigurasi Elektron
Selanjutnya, kita akan mempelajari tentang konfigurasi elektron mekanika kuantum.
Wah apa itu? Konfigurasi elektron merupakan gambaran distribusi elektron dalam orbital-orbital penyusun atom.
Elo harus tau dulu nih prinsip-prinsip dalam menyusun atom, yaitu asas aufbau, kaidah hund, dan larangan pauli.
Asas Aufbau
Asas ini menyatakan bahwa pengisian elektron dimulai dari sub kulit yang memilAturan dari konfigurasi elektron mekanika kuantum yang pertama adalah aturan menurut asas Aufbau.
Asas ini menyatakan bahwa pengisian elektron dimulai dari subkulit yang memiliki tingkat energi terendah lebih dulu. Begini urutan dari tingkat energi yang terendah hingga yang tertinggi:
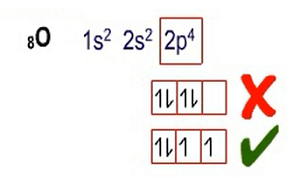
Kaidah Hund
Kaidah selanjutnya adalah kaidah hund, yang menyatakan bahwa elektron di dalam suatu orbital tidak boleh berpasangan sebelum masing-masing orbital dalam sub kulit terisi masing-masing 1 elektron. Agar lebih jelas, coba lihat pada gambar di bawah ini:
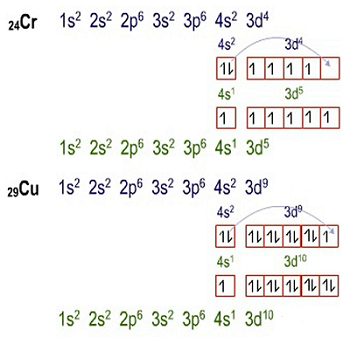
Pada kaidah hund ini juga terdapat penyimpangan konfigurasi pada sub kulit d. Ternyata, sub kulit d menyukai keadaan stabil, yaitu ketika ½ penuh dan penuh. Contohnya bisa dilihat pada kasus Cr dan Cu berikut ini:
Bisa dilihat bahwa pada orbital d sebenarnya tidak stabil karena kosong. Agar sub kulit d stabil, maka 1 elektron dari sub kulit s diberikan kepada d, sehingga d menjadi stabil.
Asas Larangan Pauli
Terakhir, aturan konfigurasi elektron mekanika kuantum adalah berdasarkan asas larangan Pauli.
Asas ini menyebutkan bahwa elektron-elektron dalam menyusun atom memiliki masing-masing empat bilangan kuantum yang berbeda. Jadi, gak bisa tuh ada yang sama bilangan kuantumnya di dalam satu atom.
Hal ini karena keempat bilangan kuantum menyatakan alamat dari suatu elektron. Coba elo lihat dari contoh di bawah ini:

Dari contoh di atas, kita bisa tau kalau tidak ada bilangan kuantum yang sama di dalam atom S tersebut. Kalau m-nya sama, maka s-nya berbeda.
Contoh Soal Bilangan Kuantum
Gimana nih guys, masih bingung gak? Udah paham dong pastinya. Biar makin paham lagi, yuk lihat contoh soal dan pembahasan di bawah ini!
Soal 1:
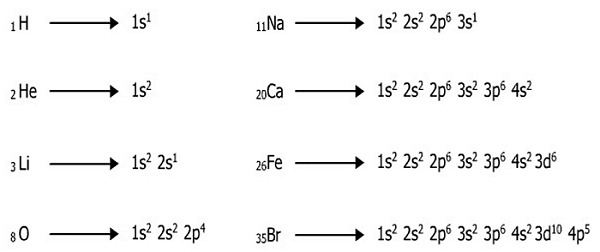
Tentukan konfigurasi elektron dari H, He, Li, O, Na, Ca, Fe, dan Br berdasarkan prinsip aufbau!
Pembahasan soal 1:
Soal 2:
Tentukan keempat bilangan kuantum elektron terakhir dari atom Na, Fe, dan Co!
Pembahasan 2:

Oke, itu dia penjelasan dari materi teori mekanika kuantum yang akan elo temui di mata pelajaran Kimia kelas 10 ini.
Sekarang udah paham ‘kan tentang mekanika kuantum? Jadi, elo udah gak perlu lagi ketakutan kalau bertemu dengan contoh-contoh soal di atas. Semoga penjelasan di atas bisa bermanfaat ya buat elo.
Oh iya, selain materi Kimia, elo juga bisa belajar mata pelajaran lainnya lho bareng Zenius. Kayak Bahasa Indonesia, Bahasa Inggris, Fisika, Matematika, dll. Kalau elo berlangganan Zenius sekarang, elo akan mendapatkan potongan harga hingga 80% lho.
Caranya gampang, elo tinggal download aplikasi Zenius atau klik banner di bawah ini ya!
Oh iya, elo juga boleh banget langsung cek di sini buat tonton video materi dari kakak tutor kimia yang super duper keren, tentunya bakal bikin elo bersahabat dengan kimia. Jangan lelah untuk belajar ya, guys! Have a nice day!
Baca Juga Artikel Lainnya
Larutan Elektrolit dan Non Elektrolit
Originally Published: January 13, 2021
Updated by: Sabrina Mulia Rhamadanty






Makasih kak buat materi nya, mudah dipahami..